pH
- Genel Kimya

Determination of pH of Common Substances
EXPERIMENT 20: Determination of pH of Common Substances Materials: pH paper and color chart (pH range 3 to 12) or pH meter…
- Genel Kimya

Etkin Ph Metre Kullanımı Nasıl olur?
Ph metre, bir çözeltideki hidrojen iyonları konsantrasyonunu bir tur logaritmik ölçümle veren cihaz. Ph’daki 7’nin altındaki değerler asidik ortamı, üstündeki değerler bazik ortamı…
- Beslenme

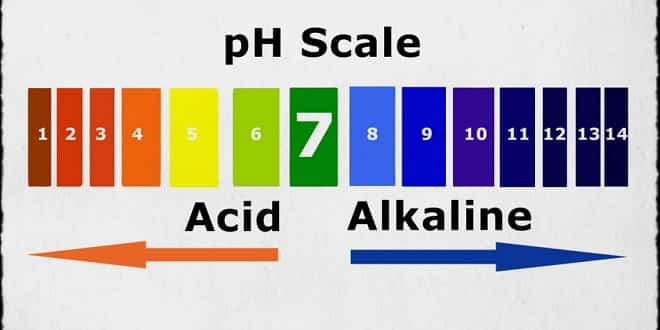
pH Nedir?
pH bir çözeltinin asit veya baz olma özelliğinin şiddetini gösteren bir terimdir. Yani çözeltide bulunan H+ iyonu konsantrasyonunun bir ifade çeşididir. pH…
- Genel Kimya

Genel Kimya Deney Raporu – Ph Deneyi
Yaptığımız deneyde bazı renklerin birbirine yakın bir şekilde çıkması bizi karşılaştırma esnasında çok zorladı. Yaptığımız deneyde pH ifadesinin tam katlarının değerleri için…
- Genel Kimya

Laboratory > Investigation Of Buffer Systems
A compound can buffer the pH of a solution only when its concentration is sufficient and when the pH of the solution…
- Genel Kimya

Laboratory > Ph and Indicators
DISCUSSION: An appropriate indicator will change colour at the equivalence point of the titration.Litmus is not used in titrations because the pH range…
- 1
- 2